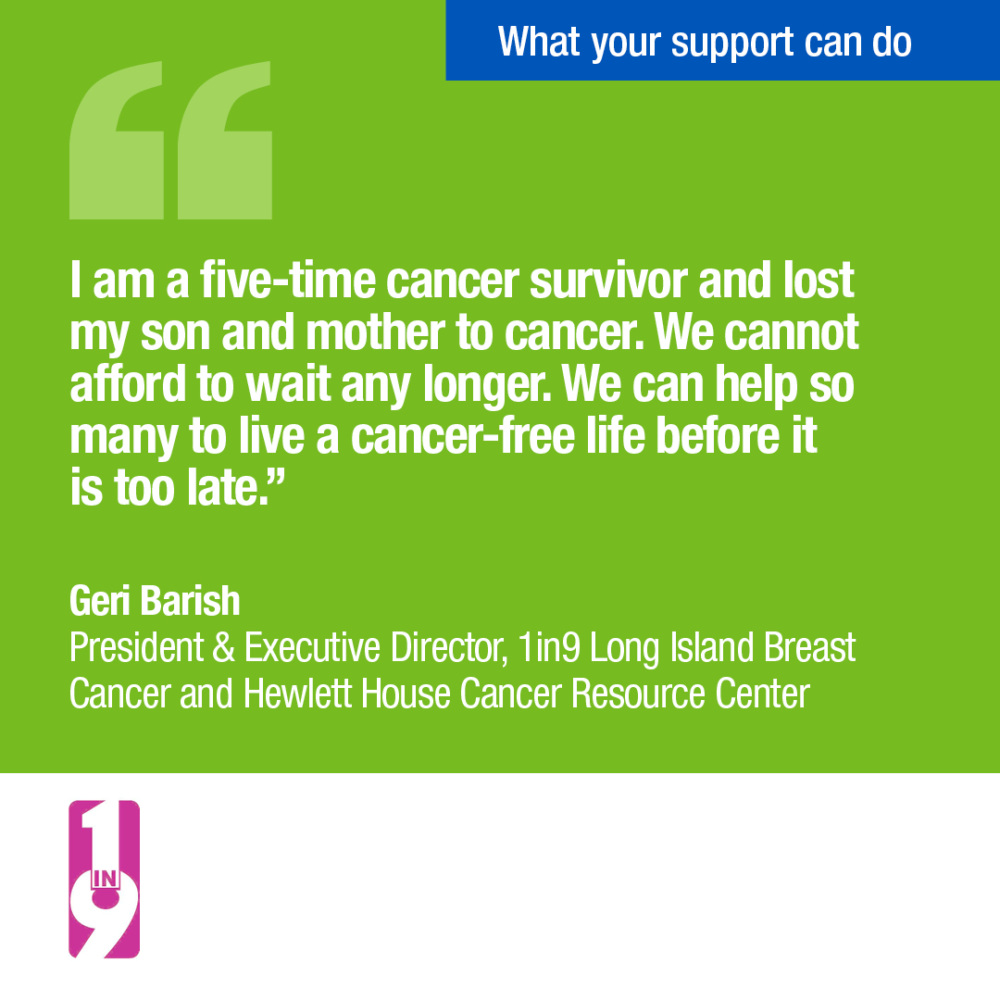DÉTECTION PRÉCOCE MULTI-CANCER
Couverture et législation
Aujourd'hui, il y a dépistages de routine recommandés pour seulement quelques-uns des plus de 200 types de cancer, laissant la plupart des cancers non détectés jusqu'à l'apparition des symptômes, souvent à des stades ultérieurs.
La Fondation Prevent Cancer soutient la législation qui reconnaît les avancées émergentes dans notre lutte contre le cancer en garantissant que les Centers for Medicare et Medicaid Services (CMS) puissent prendre une décision de couverture pour de nouveaux tests innovants capables de détecter plusieurs types de cancer.
C'est pourquoi la Fondation Prevent Cancer exhorte le Congrès à adopter la loi sur la couverture du dépistage précoce de plusieurs cancers.
Les organisations de défense soutiennent le projet de loi
The Multi-Cancer Early Detection Screening Coverage Act has the support of more than 550 leading health care and advocacy organizations across the United States, demonstrating the significant impact that it would have on a diverse set of communities throughout the U.S.
Voir la signature sur la lettre de soutienQue sont la loi Nancy Gardner Sewell sur la couverture du dépistage précoce de plusieurs cancers de Medicare et la loi sur la couverture du dépistage précoce de plusieurs cancers de Medicare ?
La Nancy Gardner Sewell Medicare Multi-Cancer Early Detection Screening Coverage Act et la Medicare Multi-Cancer Early Detection Screening Coverage Act sont des projets de loi qui moderniseraient le programme Medicare et créeraient une catégorie de prestations pour les tests MCED, ce qui permettrait aux Centers for Medicare et Medicaid Services (CMS) pour lancer un processus de couverture fondé sur des preuves pour les tests multi-cancers après l'approbation des tests par la Food and Drug Administration (FDA).
The House bill (H.R. 842) was introduced with bipartisan support on January 31, 2025, and its Senate companion (S. 339) was introduced on January 30, 2025.
Lis le full text of H.R. 842
Lis le full text of S. 339
Comment la législation MCED fonctionne-t-elle dans la pratique si elle est adoptée par le Congrès ?
La loi sur la couverture du dépistage précoce de plusieurs cancers moderniserait le programme Medicare et créerait une catégorie de prestations pour les tests MCED, ce qui permettrait aux centres de services Medicare et Medicaid (CMS) de lancer un processus de couverture fondé sur des preuves pour les tests multi-cancers auprès de la FDA. approbation.
La législation a été rédigée sur la base de la législation sur le dépistage du cancer colorectal et de la prostate issue de la loi sur l'équilibre budgétaire de 1997, qui a établi une prestation couverte pour les tests de dépistage du cancer colorectal et de la prostate et a accordé au secrétaire du ministère de la Santé et des Services sociaux (HHS) le pouvoir de couvrir les nouvelles technologies de dépistage de ces cancers.
Pourquoi l’approbation de la FDA est-elle requise ?
La loi sur la couverture du dépistage précoce de plusieurs cancers concerne les tests de dépistage et non les diagnostics. Les tests de diagnostic sont régulièrement couverts par Medicare et ne nécessitent aucune action du Congrès, mais pour que les tests de dépistage obtiennent une couverture Medicare via une détermination de couverture nationale, ils doivent entrer dans une catégorie « avantages ». (En vertu de la loi sur les soins abordables, Medicare est également tenu de couvrir les tests de dépistage de routine du cancer auxquels le groupe de travail américain sur les services préventifs attribue une note « A » ou « B ».)
La loi sur la couverture du dépistage précoce de plusieurs cancers est basée sur le précédent de l'autorisation par le Congrès de la couverture par Medicare des mammographies pour le dépistage du cancer du sein, des tests Pap pour le dépistage du cancer du col de l'utérus et des tests de dépistage des cancers colorectal et de la prostate (qui nécessitaient tous l'approbation de la FDA). ).
Les déterminations de couverture nationale de CMS pour les dépistages du cancer n'ont couvert que les tests approuvés par la FDA, notamment Cologuard (dépistage du cancer colorectal), les tests du virus du papillome humain (VPH) et un récent test de biomarqueur sanguin pour le dépistage du cancer colorectal.
Sur la base de ce précédent, les tests MCED nécessitent l’approbation de la FDA pour être pris en compte pour une détermination de couverture nationale.
Pourquoi ne pas créer une autorité de couverture pour tous les nouveaux dépistages du cancer ?
La loi sur la couverture du dépistage précoce de plusieurs cancers n’empêche aucun autre effort visant à créer une couverture pour de nouveaux tests de dépistage d’un seul cancer. La politique se concentre sur les tests multi-cancers car c’est là que les obstacles à la couverture sont les plus aigus. De nouveaux tests de détection précoce de plusieurs cancers pourraient maximiser la détection du cancer en ajoutant un outil supplémentaire à notre arsenal existant de dépistage du cancer. En créant une autorité de couverture pour les tests MCED, le Congrès peut alimenter le développement supplémentaire des dépistages multi-cancers.
La couverture ou le partage des coûts pour les dépistages existants sont-ils affectés par la législation MCED ou par ces tests ?
Non. Les dépistages existants sauvent des vies, et il est important que les patients continuent de suivre les recommandations de dépistage existantes et de bénéficier d’un partage nul des coûts. Pour cette raison, la législation stipule que la couverture des dépistages existants ne devrait pas être affectée.
Quels sont les avantages d’introduire une législation avant l’approbation de ces tests par la FDA ?
L’adoption d’une loi peut être un long processus. En commençant dès maintenant, il est possible de faire adopter une législation avant que ces nouveaux tests ne soient approuvés par la FDA et d'éviter des retards importants dans l'accès des patients. Si le Congrès attend pour introduire une législation que les tests soient approuvés par la FDA, les patients pourraient attendre plusieurs années avant de pouvoir accéder aux tests pendant que le processus législatif avance.
Ce que disent les partisans du projet de loi