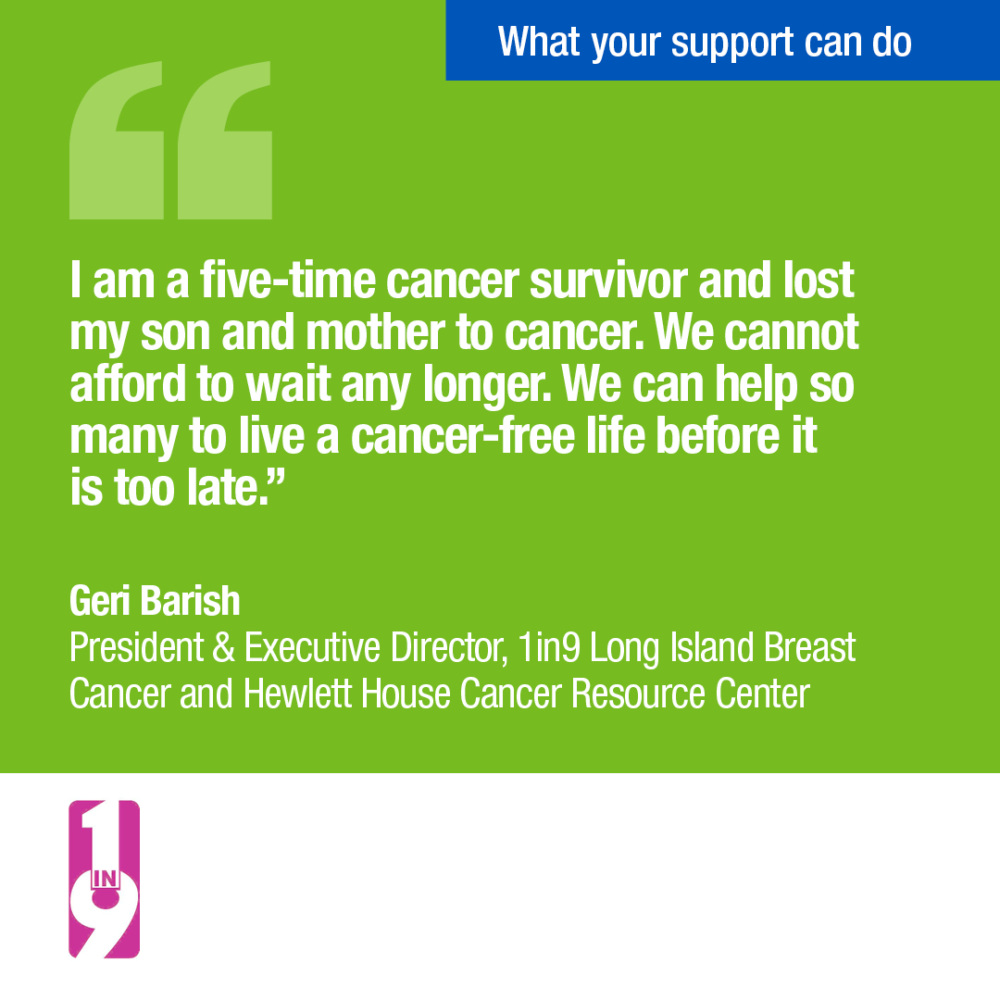Früherkennung mehrerer Krebsarten
Geltungsbereich und Gesetzgebung
Heute gibt es empfohlene Routineuntersuchungen nur für einige wenige von über 200 Krebsarten, die meisten Krebserkrankungen bleiben unerkannt, bis Symptome auftreten, oft in späteren Stadien.
Die Prevent Cancer Foundation unterstützt Gesetze, die neue Fortschritte in unserem Kampf gegen den Krebs anerkennen, indem sie sicherstellen, dass die Centers for Medicare and Medicaid Services (CMS) eine Kostenübernahmeentscheidung für neue, innovative Tests treffen können, mit denen mehrere Krebsarten erkannt werden können.
Aus diesem Grund fordert die Prevent Cancer Foundation den Kongress auf, den Multi-Cancer Early Detection Screening Coverage Act zu verabschieden.
Interessenverbände unterstützen den Gesetzentwurf
The Multi-Cancer Early Detection Screening Coverage Act has the support of more than 550 leading health care and advocacy organizations across the United States, demonstrating the significant impact that it would have on a diverse set of communities throughout the U.S.
Unterschrift auf Unterstützungsschreiben anzeigenWas sind der Nancy Gardner Sewell Medicare Multi-Cancer Early Detection Screening Coverage Act und der Medicare Multi-Cancer Early Detection Screening Coverage Act?
Der Nancy Gardner Sewell Medicare Multi-Cancer Early Detection Screening Coverage Act und der Medicare Multi-Cancer Early Detection Screening Coverage Act sind Gesetzentwürfe zur Modernisierung des Medicare-Programms und zur Schaffung einer Leistungskategorie für MCED-Tests, die es den Centers for Medicare and Medicaid Services (CMS) ermöglichen würde, nach der Zulassung der Tests durch die Food and Drug Administration (FDA) ein evidenzbasiertes Kostenerstattungsverfahren für Tests auf mehrere Krebsarten einzuleiten.
The House bill (H.R. 842) was introduced with bipartisan support on January 31, 2025, and its Senate companion (S. 339) was introduced on January 30, 2025.
Lies das full text of H.R. 842
Lies das full text of S. 339
Wie funktioniert die MCED-Gesetzgebung in der Praxis, wenn sie vom Kongress verabschiedet wird?
Der Multi-Cancer Early Detection Screening Coverage Act würde das Medicare-Programm modernisieren und eine Leistungskategorie für MCED-Tests schaffen, die es den Centers for Medicare and Medicaid Services (CMS) ermöglicht, nach der Genehmigung durch die FDA einen evidenzbasierten Kostenerstattungsprozess für Tests auf mehrere Krebsarten einzuleiten.
Der Gesetzentwurf basierte auf den Gesetzen zur Darmkrebs- und Prostatakrebsvorsorge aus dem Balanced Budget Act von 1997, der eine Kostenerstattung für Darmkrebs- und Prostatakrebsvorsorgeuntersuchungen vorsah und dem Minister des Gesundheitsministeriums (HHS) die Befugnis erteilte, die Kosten für neue Vorsorgetechnologien für diese Krebsarten zu übernehmen.
Warum ist eine FDA-Zulassung erforderlich?
Der Multi-Cancer Early Detection Screening Coverage Act ist für Screening-Tests, nicht für Diagnostik gedacht. Diagnostik-Tests werden routinemäßig von Medicare übernommen und erfordern keine Maßnahmen des Kongresses, aber um Screening-Tests durch eine National Coverage Determination von Medicare übernehmen zu lassen, müssen sie in eine „Leistungskategorie“ passen. (Im Rahmen des Affordable Care Act ist Medicare auch verpflichtet, routinemäßige Krebs-Screening-Tests zu übernehmen, die von der US Preventive Services Task Force mit der Note „A“ oder „B“ bewertet werden.)
Das Multi-Cancer Early Detection Screening Coverage Act basiert auf dem Präzedenzfall der Genehmigung der Kostenübernahme durch die staatliche Krankenversicherung Medicare für Mammographien zur Brustkrebsvorsorge, Pap-Tests zur Vorsorge gegen Gebärmutterhalskrebs sowie Vorsorgeuntersuchungen für Dickdarm- und Prostatakrebs durch den US-Kongress (für die jeweils die Genehmigung der FDA erforderlich war).
Die „National Coverage Determinations“ des CMS für Krebsvorsorgeuntersuchungen sehen lediglich eine Kostendeckung für von der FDA zugelassene Tests vor, darunter Cologuard (Vorsorgeuntersuchung auf Dickdarmkrebs), Tests auf humane Papillomviren (HPV) und einen kürzlich durchgeführten Bluttest zur Vorsorgeuntersuchung auf Dickdarmkrebs.
Basierend auf diesem Präzedenzfall benötigen MCED-Tests die Genehmigung der FDA, um für eine nationale Abdeckungsbestimmung berücksichtigt zu werden.
Warum wird keine Kostenübernahme für alle neuen Krebsvorsorgeuntersuchungen geschaffen?
Das Multi-Cancer Early Detection Screening Coverage Act verhindert keine anderen Bemühungen, eine Kostendeckung für neue Einzelkrebs-Screeningtests zu schaffen. Die Richtlinie konzentriert sich auf Multikrebstests, da hier die Kostendeckungsbarrieren am größten sind. Neue Multikrebs-Früherkennungstests könnten die Krebserkennung maximieren, indem sie unser bestehendes Arsenal an Krebs-Screenings um ein zusätzliches Instrument ergänzen. Indem der Kongress die Kostendeckungsbefugnis für MCED-Tests schafft, kann er die weitere Entwicklung von Multikrebs-Screenings vorantreiben.
Wird die Deckung oder Kostenbeteiligung für bestehende Screenings durch die MCED-Gesetzgebung oder diese Tests beeinflusst?
Nein. Bestehende Screenings retten Leben, und es ist wichtig, dass die Patienten weiterhin die bestehenden Screening-Empfehlungen befolgen und von der Kostenbeteiligung profitieren. Aus diesem Grund besagt die Gesetzgebung, dass die Kostenübernahme für bestehende Screenings nicht beeinträchtigt werden sollte.
Welche Vorteile bietet die Einführung von Gesetzen vor der FDA-Zulassung dieser Tests?
Die Verabschiedung von Gesetzen kann ein langwieriger Prozess sein. Wenn wir jetzt damit beginnen, ist es möglich, dass die Gesetze bis zur Zulassung dieser neuen Tests durch die FDA verabschiedet werden und erhebliche Verzögerungen beim Zugang der Patienten vermieden werden. Wenn der Kongress mit der Verabschiedung von Gesetzen wartet, bis die Tests durch die FDA zugelassen sind, könnten die Patienten mehrere Jahre warten müssen, bis sie Zugang zu den Tests erhalten, während der Gesetzgebungsprozess voranschreitet.
Was die Befürworter des Gesetzes sagen